医疗器械软件描述文档及体系文件模板word版doc 可编辑.docx
http://www.100md.com
2020年10月23日
参见附件(161KB,0页)。
医疗器械管理必备文档
医院或者是专门整理医疗器械的朋友必备的一个模板文件,医疗器械软件描述文档及体系文件模板word版是最新出的本,支持编辑,可以直接编辑然后打印超级方便实用。
内容预览
1.1.产品标识
软件名称:
软件型号:
软件版本号:
软件制造商:
软件生产地址:
1.2.安全性级别
软件的安全性级别为A/B/C级。理由如下:
a)软件的预期用途为
b)软件的功能包括:
c)如果软件失效,可能导致以下后果(按软件各功能失效逐条描述,如果软件失效的时候由硬件降低失效后果或危害发生概率,可以做说明,并由此降低安全性级别):
1)
2)
3)
医疗器械软件描述文档及体系图片预览
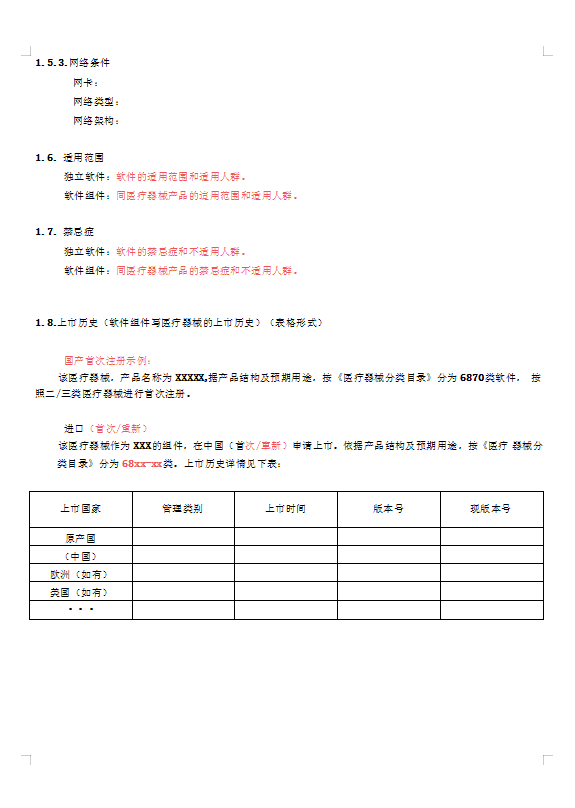

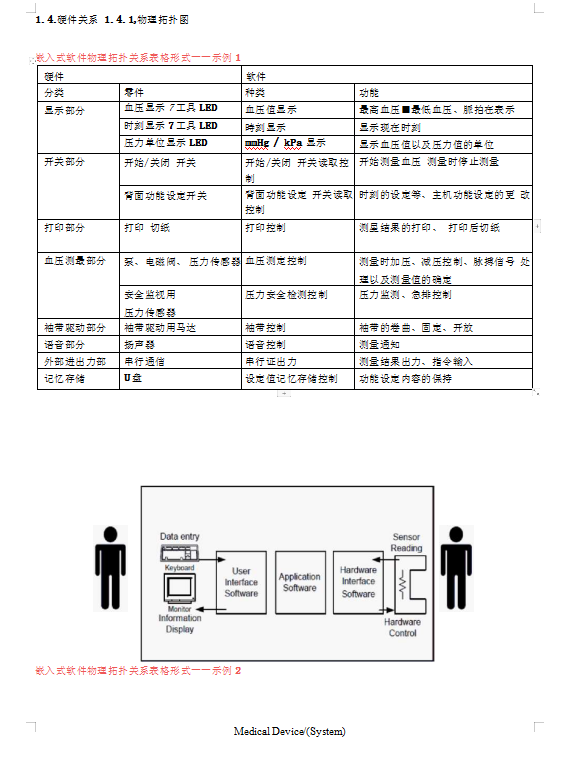
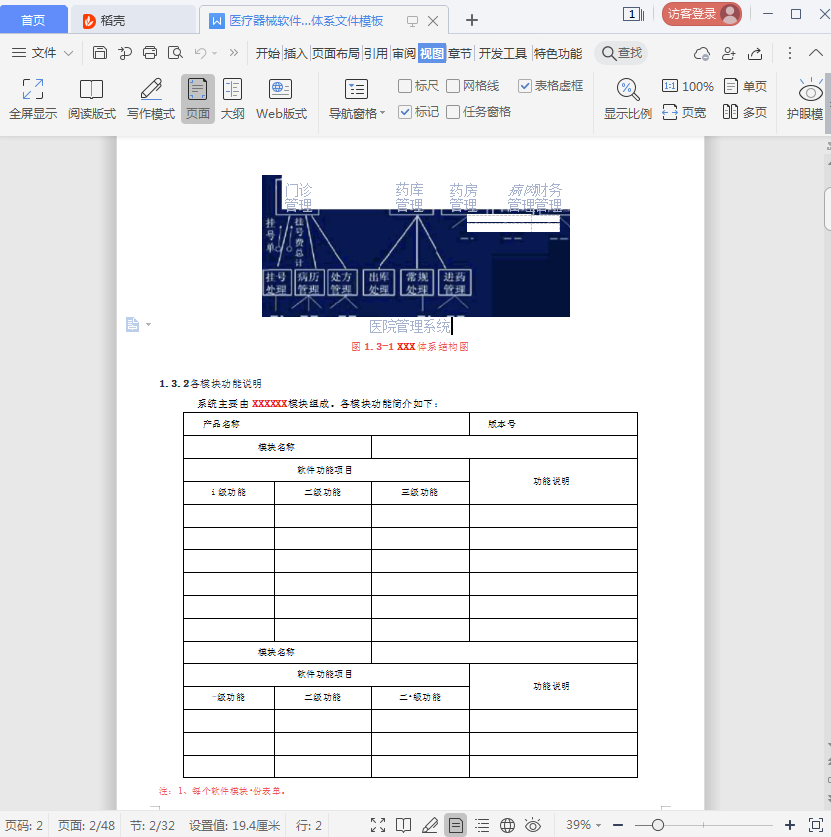
现成软件记录说明
根据CFDA 2015年8月5日发布的《国家食品药品监督管理总局关于发布医疗器械软件注册技术审查指导原则的通告(2015年第50号)》所有包含软件的第二类、第三类医疗器械产品,软件开发方式无论是自主开发、部分采用现成软件和全部采用现成软件,均应在首次注册时提交软件描述文档。软件描述文档的详略程度、条款要求均因安全性级别和开发方式的不同而有所差异。
针对自主研发的医疗器械软件,软件描述文档包括基本信息、实现过程和核心算法(详见附件)。
部分采用现成软件
对于全部采用现成软件的方式,三种现成软件的要求有所不同:
成品软件:制造商应提供外购合同复印件或声明、软件描述文档(不适用条款说明理由),成品软件如已在中国上市提供注册证复印件;
遗留软件:制造商应提供遗留软件证明性文件(如YY/T 0664或IEC 62304实施之前的注册证或上市批书复印件)、软件描述文档(不适用条款说明理由)、上市后临床评价资料;
外包软件:制造商应提供外包合同复印件或声明、软件描述文档(不适用条款说明理由)。
医疗器械软件描述文档及体系文件模板word版截图
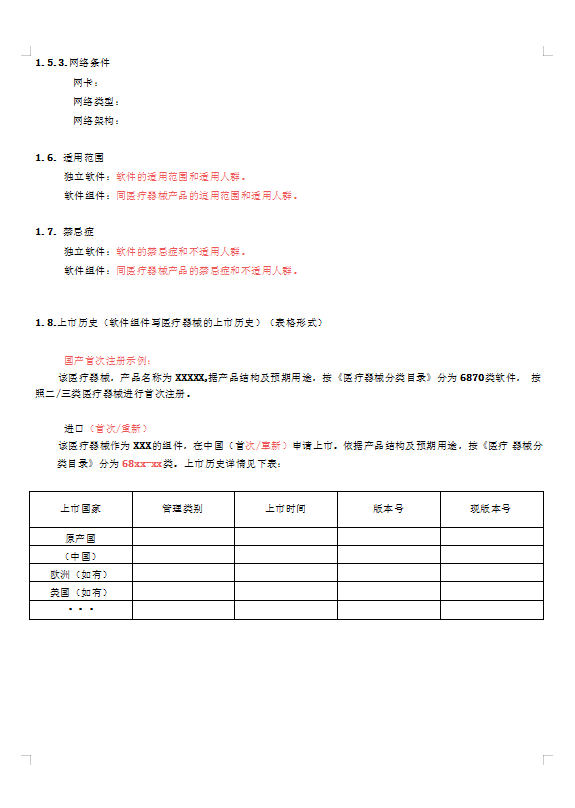
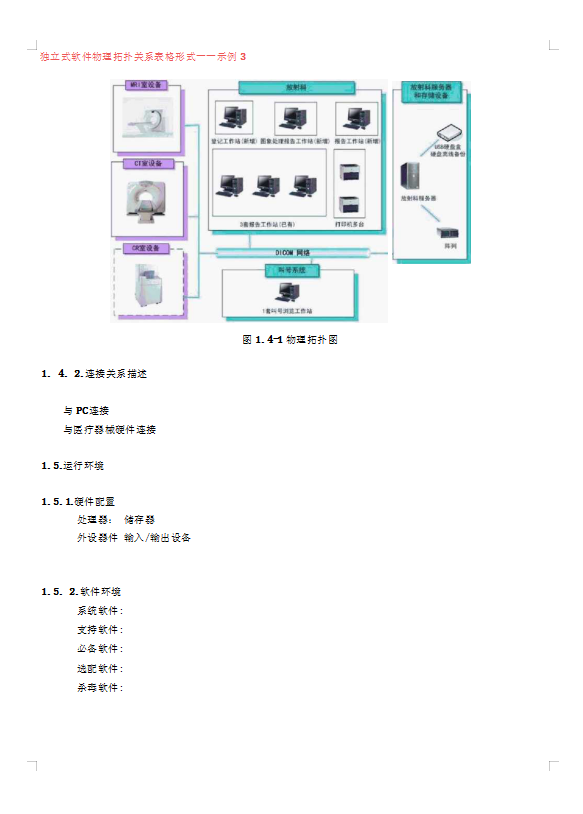
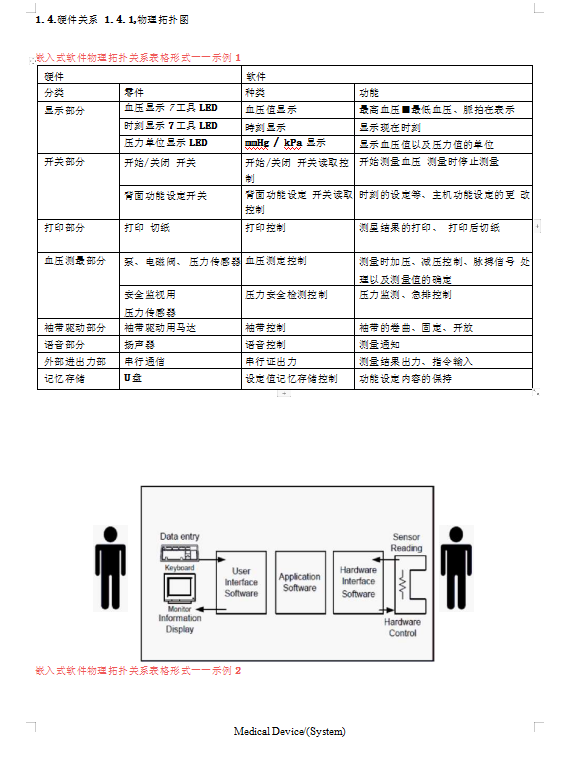

医疗器械管理必备文档
医院或者是专门整理医疗器械的朋友必备的一个模板文件,医疗器械软件描述文档及体系文件模板word版是最新出的本,支持编辑,可以直接编辑然后打印超级方便实用。

内容预览
1.1.产品标识
软件名称:
软件型号:
软件版本号:
软件制造商:
软件生产地址:
1.2.安全性级别
软件的安全性级别为A/B/C级。理由如下:
a)软件的预期用途为
b)软件的功能包括:
c)如果软件失效,可能导致以下后果(按软件各功能失效逐条描述,如果软件失效的时候由硬件降低失效后果或危害发生概率,可以做说明,并由此降低安全性级别):
1)
2)
3)
医疗器械软件描述文档及体系图片预览





现成软件记录说明
根据CFDA 2015年8月5日发布的《国家食品药品监督管理总局关于发布医疗器械软件注册技术审查指导原则的通告(2015年第50号)》所有包含软件的第二类、第三类医疗器械产品,软件开发方式无论是自主开发、部分采用现成软件和全部采用现成软件,均应在首次注册时提交软件描述文档。软件描述文档的详略程度、条款要求均因安全性级别和开发方式的不同而有所差异。
针对自主研发的医疗器械软件,软件描述文档包括基本信息、实现过程和核心算法(详见附件)。
部分采用现成软件
对于全部采用现成软件的方式,三种现成软件的要求有所不同:
成品软件:制造商应提供外购合同复印件或声明、软件描述文档(不适用条款说明理由),成品软件如已在中国上市提供注册证复印件;
遗留软件:制造商应提供遗留软件证明性文件(如YY/T 0664或IEC 62304实施之前的注册证或上市批书复印件)、软件描述文档(不适用条款说明理由)、上市后临床评价资料;
外包软件:制造商应提供外包合同复印件或声明、软件描述文档(不适用条款说明理由)。
医疗器械软件描述文档及体系文件模板word版截图





您现在查看是摘要介绍页, 详见DOCX附件(161KB,0页)。